ブログ総もくじ 伏見啓明整形外科公式サイト Coロナ関連記事目次 今、電子カルテがあぶない 個人情報談義 目次
https://www.mdpi.com/2076-393X/11/5/991
IgG4 Role in Cancer
癌におけるIgG4の役割
Immune
checkpoint inhibitors, often known as cancer immunotherapy agents,
prevent checkpoint proteins from attaching with their associated
polypeptides, allowing cytotoxic CD8+ T lymphocytes (CTLs) to attack
cancer cells.
免疫チェックポイント阻害剤は、しばしば癌免疫療法剤として知られ、チェックポイント蛋白が関連するポリペプチドとくっつくのを防ぎ、細胞傷害性CD8+Tリンパ球(CTL)が癌細胞を攻撃できるようにする。
Immune checkpoint-blocking (ICB) agents include
anti-CTLA-4 (cytotoxic T-lymphocyte antigen 4) and anti-PD-1 (programmed
cell death protein 1) monoclonal antibodies [87,88].
免疫チェックポイント阻害剤(ICB)には、抗CTLA-4(細胞傷害性Tリンパ球抗原4)および抗PD-1(プログラム細胞死タンパク質1)モノクローナル抗体が含まれる[87,88]。
ICB has demonstrated therapeutic effectiveness in a wide range of cancer types, including advanced-stage cancer patients [89,90,91].
ICBは、進行期がん患者を含む幅広いがん種で治療効果を示している [89,90,91] 。
Regrettably, only 15–30% of cancer patients who have received treatment benefit from ICB’s therapeutic efficacy [92].
残念なことに、ICBの治療効果を享受できるのは、治療を受けたがん患者の15〜30%に過ぎない [92]。
Most crucially, new reports show that certain cancer patients receiving
anti-PD-1 monoclonal antibody treatment have rapid disease progression
(also known as hyper progressive disease (HPD) instead of cancer
remission [93,94,95].
最も重大なことは、抗PD-1モノクローナル抗体治療を受けたある種の癌患者では、癌の寛解ではなく、急速な病勢進行(超進行性病変(HPD)としても知られている)が見られるという新たな報告である[93,94,95]。
Notably, the PD-1 antibody belongs to the IgG4 family. Furthermore, cancers, such as malignant melanoma [48], extrahepatic cholangiocarcinoma [96], and pancreatic cancer [97],
have been linked to plasma B-cell infiltrates that are IgG4-positive.
注目すべきは、PD-1抗体がIgG4ファミリーに属していることである。さらに、悪性黒色腫 [48]、肝外胆管癌 [96]、膵臓癌 [97] などの癌は、IgG4陽性の血漿B細胞浸潤と関連している。
IgG4′s contribution to cancer is poorly understood, but a groundbreaking
study has added important new knowledge.
IgG4の癌への寄与はあまり理解されていないが、ある画期的な研究によって重要な新知見が加わった。
Karagiannis et al. [48]
studied malignant melanoma and found that IL-4 and IL-10 expression was
elevated and that tumor-specific IgG4 was generated locally in the
tumor tissues.
Karagiannisら[48]は悪性黒色腫を研究し、IL-4とIL-10の発現が上昇し、腫瘍組織で腫瘍特異的IgG4が局所的に生成されることを発見した。
It is common to think of IL-10 as an anti-inflammatory
cytokine; however, this is only true in low quantities, as at larger
concentrations, it shows pro-inflammatory effects [98,99,100].
IL-10は抗炎症性サイトカインであると考えるのが一般的であるが、これは低濃度においてのみ当てはまることであり、高濃度では炎症促進作用(pro-inflammatory effects )を示す [98,99,100] 。
Karagiannis et al. [48]
also found that, in contrast to cancer-specific IgG1, cancer-specific
IgG4 failed to activate two immunological processes that employ
antibodies to identify and destroy cancer cells.
Karagiannisら[48]はまた、がん特異的IgG1とは対照的に、がん特異的IgG4は、がん細胞を同定し破壊するために抗体を用いる2つの免疫学的プロセスを活性化できないことを発見した。
Moreover, the IgG1
antibody was able to suppress cancer progression in an in vivo model,
while IgG4 failed to do so.
さらに、IgG1抗体はin vivoモデルにおいて癌の進行を抑制することができたが、IgG4はそれができなかった。
IgG4 antibodies cannot directly attack tumor
cells and can interfere with the process of tumor cell death mediated
by IgG1 antibodies.
IgG4抗体は腫瘍細胞を直接攻撃することができず、IgG1抗体によって媒介される腫瘍細胞死のプロセスを妨害する可能性がある。
The inhibition of IgG1 binding and activation by Fc
RI is the mechanism behind this obstructing activity.
Fc RIによるIgG1結合と活性化の阻害が、この阻害活性の背後にあるメカニズムである。
Such findings
point to a previously un-researched feature of tumor-induced immune
escape: IgG4 synthesis induced by tumors limits effector immune cell
activities against tumors [48].
腫瘍によって誘導されたIgG4合成が、腫瘍に対するエフェクター免疫細胞の活性を制限しているのである。
Another work [101]
came to the same conclusion; that is, the IgG4 antibody is important
and necessary for cancer immune evasion.
別の研究 [101] でも同じ結論が得られた。すなわち、IgG4抗体は癌の免疫逃避に重要かつ必要であるということである
In a cohort of individuals with
esophageal cancer, B cells producing high IgG4 concentrations were
markedly raised in malignant cells and also high in serum samples from
patients.
食道癌患者のコホートでは、高濃度のIgG4を産生するB細胞が悪性細胞で顕著に上昇し、患者の血清サンプルでも高濃度であった。
More IgG4 seems to be linked to more aggressive cancer growth,
and both were strongly associated with higher cancer malignancy and
poor prognosis.
より多くのIgG4は、より攻撃的な癌の増殖と関連しているようであり、両者とも癌の悪性度が高く予後不良と強く関連していた。
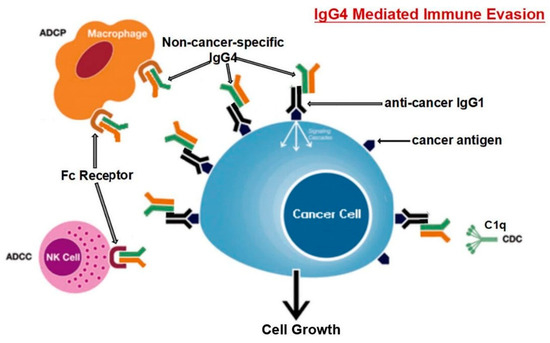
It was discovered that IgG4 can contend with IgG1 (as
shown in Figure 3)
in binding to Fc receptors present in some immune cells in vitro.
IgG4は、in vitroでいくつかの免疫細胞に存在するFcレセプターに結合する際、IgG1(図3に示す)と競合できることが発見された。
This
competition results in the inhibition of typical immune responses
against cancer cells, such as cell and complement cytotoxicity and cell
phagocytosis, which are mediated by IgG1 antibodies.
この競合の結果、IgG1抗体によって媒介される細胞や補体の細胞傷害性、細胞の貪食性といった、がん細胞に対する典型的な免疫応答が阻害される。
Figure 3.
The suggested pathway for immune evasion evolved by cancer cells through
IgG4 produced from B lymphocytes is depicted diagrammatically.
図3. Bリンパ球から産生されるIgG4を通してがん細胞が進化させた免疫回避の経路を図式化したもの。
Prolonged exposure to cancer antigens causes B cells to change their
class and generate IgG4.
がん抗原に長期間さらされると、B細胞はそのクラスを変化させ、IgG4を生成する。
With its Fc-Fc binding characteristic, such
enhanced IgG4 can interact with cancer-bound IgG as well as Fc receptors
on immune effector cells.
Fc-Fc結合特性を持つこのような増加したIgG4は、免疫エフェクター細胞上のFcレセプターだけでなく、がんに結合したIgGとも相互作用することができる。
Increased IgG4 in the cancer microenvironment
promotes an efficient immune evasion mechanism for cancer due to its
special structural and biological properties.
がん微小環境におけるIgG4の増加は、その特殊な構造的・生物学的特性により、がんに対する効率的な免疫回避機構を促進する。 The acronyms ADCC, ADCP,
CDC, and NK stand for antibody-dependent cell-mediated cytotoxicity,
antibody-dependent cell phagocytosis, complement-dependent cytotoxicity,
and natural killer cells, respectively.
ADCC、ADCP、CDC、NKはそれぞれ、抗体依存性細胞媒介性細胞傷害、抗体依存性細胞貪食、補体依存性細胞傷害、ナチュラルキラー細胞を表す。
Reproduced from [101].
101]より転載。
This is an open-access article distributed under the Creative Commons
Attribution Non-Commercial (CC BY-NC 4.0) license, which permits others
to distribute, remix, adapt, build upon this work non-commercially, and
license their derivative works on different terms, provided the original
work is properly cited, appropriate credit is given, any changes made
indicated, and the use is non-commercial.
この記事は、クリエイティブ・コモンズ 表示 非商用(CC BY-NC 4.0)ライセンスの下で配布されているオープンアクセス記事である。このライセンスは、原著作物が適切に引用され、適切なクレジットが付与され、いかなる変更も明記され、使用が非商用であることを条件として、他の人がこの作品を非商用的に配布、リミックス、翻案、構築し、その派生作品を異なる条件でライセンスすることを許可するものである。
(図の説明 終わり)
Locally elevated levels of IgG4 in cancer
tissue hindered antibody-mediated anticancer responses, assisted cancer
in blocking the local immune response and indirectly aided in cancer
progression.
がん組織におけるIgG4レベルの局所的上昇は、抗体を介した抗がん反応を阻害し、がんが局所免疫反応を阻害するのを助け、間接的にがんの進行を助けた。
Three separate immune-potent mice models supported this
theory.
この説は、3つの別々の免疫増強マウスモデルによって支持された。
It was discovered that local administration of IgG4 dramatically
sped up the growth of implanted colorectal and breast tumors as well as
skin papillomas caused by carcinogens.
IgG4の局所投与は、移植した大腸腫瘍や乳腺腫瘍、発癌物質による皮膚乳頭腫の成長を劇的に早めることが発見された。
Researchers also examined the
IgG4 antibody Nivolumab, which is used in cancer immunotherapy, and
discovered that it dramatically accelerated the development of cancer in
mice when compared to phosphate buffer saline (PBS) and IgG1-treated
groups [101].
研究者たちはまた、がん免疫療法に用いられるIgG4抗体ニボルマブについても検討し、リン酸緩衝生理食塩水(PBS)投与群やIgG1投与群と比較して、マウスにおけるがんの発生を劇的に促進することを発見した[101]。
Researchers
used models of immunologically competent mice to evaluate their
hypothesis and further explore the mechanism mediated by such
antibodies.
研究者たちは、自分たちの仮説を評価し、そのような抗体が介在するメカニズムをさらに探求するために、免疫学的に有能なマウスのモデルを使用した。
One model involved injecting non-cancer-specific IgG4 into
the subcutaneous inoculation site for breast cancer cells.
あるモデルでは、乳癌細胞の皮下接種部位に非癌特異的IgG4を注射した。
In comparison
to other groups of mice (injected with PBS or IgG1 without IgG4), this
group’s cancer cell proliferation was dramatically accelerated,
generating a significantly larger cancer mass by 21 days.
他のマウス群(PBSまたはIgG4を含まないIgG1を注射)と比較すると、この群のがん細胞増殖は劇的に促進され、21日後までに有意に大きながん塊を生成した。
Because IgG4
has no direct influence on cancer cell proliferation, these findings
unambiguously indicate that cancer cells utilize the IgG4 antibody to
block local immunological responses and thus allow cancer growth in vivo
via immune escape.
IgG4はがん細胞の増殖に直接影響を与えないため、これらの知見は、がん細胞がIgG4抗体を利用して局所的な免疫学的反応をブロックし、免疫逃避を介して生体内でのがん増殖を可能にしていることを明確に示している。
This could explain the recently discovered
hyper-progressive syndrome that is occasionally linked to cancer
treatment with PD-1 inhibitors [101].
このことは、最近発見されたPD-1阻害剤によるがん治療と時折関連する過進行症候群を説明できるかもしれない[101]。
The
immune system can detect cancers that might otherwise escape immune
surveillance thanks to immune checkpoint inhibitory therapeutic
antibodies that attach to the programmed cell death protein 1 (PD-1)
receptor.
プログラム細胞死タンパク質1(PD-1)レセプターに結合する免疫チェックポイント阻害治療抗体のおかげで、免疫系は、そうでなければ免疫監視から逃れる可能性のある癌を検出することができる。
Yet, IgG4 antibodies can also cause an autoimmune reaction by
impeding the immune system’s ability to be suppressed by regulatory T
cells [102].
Intriguingly, the anti-PD-1 antibodies are class IgG4, raising the
concern that this therapy is a double-edged sword.
しかし、IgG4抗体は、制御性T細胞によって抑制される免疫系の能力を阻害することによって、自己免疫反応を引き起こす可能性もある [102] 。興味深いことに、抗PD-1抗体はクラスIgG4であり、この治療法は諸刃の剣であるという懸念がある。
For instance,
patients using immune checkpoint inhibitors alone or in combination have
been linked to occurrences of acute myocarditis [103,104,105,106], sometimes with lethal consequences [107].
例えば、免疫チェックポイント阻害剤を単独あるいは併用した患者は、急性心筋炎を発症し [103,104,105,106]、時には致死的な結果をもたらすことがある [107]。
目次
https://www.mdpi.com/2076-393X/11/5/991
IgG4 Antibodies Induced by Repeated Vaccination May Generate Immune Tolerance to the SARS-CoV-2 Spike Protein
繰り返されるワクチン接種により産生されるIgG4はSARS-CoV-2 Spike Proteinに対する免疫寛容を誘起する可能性がある
Abstract
Introduction
2. Characteristics of the Unusual IgG4 Antibody2. 特異なIgG4抗体の特徴
2.1.2. IgG4-Related Disease and Its Pathogenesis 2.1.2. IgG4関連疾患とその病態
IgG4 Role in Cancer 癌におけるIgG4の役割
3. The Role of IgG4 Antibodies Induced by Different Vaccines 3. 異なるワクチンによって誘導されるIgG4抗体の役割
3.2. Repeated Vaccination 3.2. 反復接種
3.2.1. Repeated Inoculation with COVID-19 Vaccines 3.2.1. COVID-19ワクチンの反復接種
3.2.2. Repeated Inoculation with HIV Vaccines (3.2.2. HIVワクチンの反復接種)
HIVワクチン、マラリアワクチンの反復接種、使用したワクチンの種類に関する知見


0 件のコメント:
コメントを投稿