ブログ総もくじ 伏見啓明整形外科公式サイト Coロナ関連記事目次 今、電子カルテがあぶない 個人情報談義 目次
https://www.mdpi.com/2076-393X/11/5/991
4. Discussion
Recent
studies have raised concerns that inoculation with mRNA-based COVID-19
vaccines might result in the establishment of tolerance against the
spike protein generated by host cells in response to vaccination.
最近の研究では、mRNAベースのCOVID-19ワクチンを接種すると、ワクチン接種に反応して宿主細胞で生成されるスパイク蛋白に対する耐性が確立されるのではないかという懸念が提起されている。
For
example, a recent work by Irrgang et al. discovered that several months
after the second immunization with the Pfizer vaccine,
SARS-CoV-2-specific antibodies were mainly composed of non-neutralizing
IgG4 antibodies, which were enhanced even more by a third mRNA
vaccination and/or SARS-CoV-2 variant breakthrough infections [30].
例えば、Irrgangらによる最近の研究では、ファイザーワクチンによる2回目の免疫の数ヵ月後、SARS-CoV-2特異的抗体は主に非中和IgG4抗体で構成され、この抗体は3回目のmRNAワクチン接種および/またはSARS-CoV-2亜種の画期的な感染によってさらに増強されることが発見された[30]。
The authors commented that “independent of the underlying mechanism,
the induction of antiviral IgG4 antibodies is a phenomenon infrequently
described and raises important questions about its functional
consequences” [30].
著者らは、「基礎となるメカニズムとは無関係に、抗ウイルスIgG4抗体の誘導はあまり報告されていない現象であり、その機能的帰結について重要な問題を提起している」とコメントしている[30]。
IgG4 antibodies are bi-functional: they can be protective but can also be directly pathogenic [127].
IgG4抗体は二重機能性であり、防御的であるが、直接病原性を示すこともある [127] 。
There has been a lot of research on IgG4 in chronic allergen exposure
models, where natural immunological tolerance is induced by giving an
allergen in increasing doses [128].
慢性アレルゲン暴露モデルにおけるIgG4に関する研究は数多く行われており、アレルゲンの投与量を増やすことで自然免疫寛容が誘導される [128] 。 The increase in IgG4 levels after the third immunization with the
Pfizer vaccine could reflect a tolerance mechanism that could prevent
immune over-reactivity (cytokine storm) and progression to a critical
stage [30].
ファイザーワクチンによる3回目の免疫後のIgG4レベルの上昇は、免疫の過剰反応(サイトカインストーム)と臨界期への進行を防ぐ寛容メカニズムを反映している可能性がある [30] 。
However, this exacerbated immune reaction does not occur in young and
healthy people, and it has been documented only in older patients with
genetic susceptibility and those with comorbidities [129].
しかし、このような免疫反応の増悪は、若くて健康な人では起こらず、遺伝的感受性のある高齢の患者や併存疾患のある患者でのみ報告されている [129] 。
It
has been suggested that an increase in IgG4 levels could have a
protective role similar to that occurring during successful
allergen-specific immunotherapy by inhibiting IgE-induced effects [30].
IgG4レベルの上昇は、IgE誘発作用を抑制することにより、アレルゲン特異的免疫療法の成功時に起こるのと同様の保護的役割を果たす可能性が示唆されている [30] 。
Allergen tolerance is an immune system adaptation characterized by a
particular non-inflammatory response to an allergen that, under other
conditions, would probably result in cell-mediated or humoral immunity,
which would cause tissue inflammation and/or IgE synthesis [128].
アレルゲン寛容とは、アレルゲンに対する特定の非炎症性反応を特徴とする免疫系の適応であり、他の条件下では、おそらく細胞媒介性免疫または体液性免疫が生じ、組織の炎症および/またはIgEの合成を引き起こすであろう [128] 。
In other words, the immune system “learns” to tolerate a foreign,
although innocuous, antigen.
言い換えれば、免疫系は、無害ではあるが外来抗原を許容することを「学習する」のである。
However, a very different situation occurs
when a virus invades our body.
しかし、ウイルスが私たちの体内に侵入してきた場合には、全く異なる状況が生じる。
In this scenario, vaccine-induced
tolerance can potentially have several negative, unintended consequences
because tolerance to the spike protein could inhibit the immune system
from detecting and attacking the pathogen (Figure 4);
このシナリオでは、ワクチンによって誘導された耐性が、いくつかの否定的で意図しない結果をもたらす可能性がある。なぜなら、スパイクタンパク質に対する耐性が、免疫系が病原体を検出し攻撃するのを阻害する可能性があるからである(図4)
thus, potentially exacerbating SARS-CoV2 pathology in susceptible
individuals who suffer re-infection of COVID-19 in the setting of
vaccine-induced immune suppression.
;したがって、ワクチンによって誘導された免疫抑制の設定において、COVID-19の再感染を受けた感受性の高い人のSARS-CoV2病態を悪化させる可能性がある。
For example, it was demonstrated
that patients with severe COVID-19 who passed away had higher IgG4
levels than those who recovered [28].
例えば、死亡した重症COVID-19患者は、回復した患者よりもIgG4値が高いことが証明されている[28]。
More precisely, the death rate increased noticeably at 30 days when
serum IgG4 concentrations were above 700 mg/dL, and the ratio of IgG4 to
IgG1 was above 0.05 [29].
より正確には、血清IgG4濃度が700mg/dLを超え、IgG4とIgG1の比が0.05を超えると、30日後の死亡率が顕著に上昇した。
Moreover, IgG4 levels were correlated with IL-6 levels [130], a known determinant of COVID-19-related mortality [130,131,132].
さらに、IgG4濃度はIL-6濃度と相関しており[130]、これはCOVID-19に関連した死亡率の決定因子として知られている[130,131,132]。
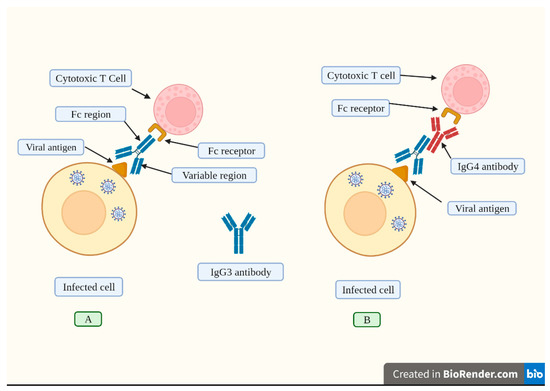
Figure 4.
An effective humoral response induced by vaccination consists of the synthesis of high IgG3 concentrations.
図4. ワクチン接種によって誘導される効果的な体液性応答は、高濃度のIgG3の合成からなる。
(A).
IgG3 antibodies attach to viral antigens exposed on infected cells’
membranes through its variable region.
(A). IgG3抗体は、その可変領域を介して感染細胞膜上に露出したウイルス抗原に結合する。
This antibody has a constant
region (Fc) that is recognized by the corresponding receptor found on
cytotoxic T cells and other immune cells.
この抗体は定常領域(Fc)を持ち、細胞傷害性T細胞や他の免疫細胞に見られる対応するレセプターに認識される。
The cytotoxic T cell becomes
activated and releases chemical agents that destroy the infected cell.
細胞傷害性T細胞は活性化され、感染細胞を破壊する化学物質を放出する。
(B).
Repeated vaccination induces high IgG4 levels (depicted in red).
(B). ワクチン接種を繰り返すと、高いIgG4レベルが誘導される(赤で描かれている)。
This
antibody inhibits the attachment of the Fc region from the IgG3 antibody
to its receptor located on cytotoxic T cells, thus blocking its
activation, and consequently, the infected cell is not destroyed.
この抗体はIgG3抗体のFc領域が細胞傷害性T細胞上のレセプターに結合するのを阻害するため、その活性化が阻害され、その結果感染細胞は破壊されない。
In
this sense, repeated boosting causes a switch to the production of high
IgG4 levels, which impair immune responses.
この意味で、ブースティングを繰り返すとIgG4が大量に産生されるようになり、免疫応答が損なわれる。
Created with Biorender.
Biorenderで作成。(橋本:図の説明はこれで終わり)
This leads us to conclude that it is incorrect
to compare the increase in IgG4 levels between allergy treatments and
the reported increase in IgG4 antibodies after repeated vaccination or
infection with SARS-CoV-2.
このことから、アレルギー治療によるIgG4レベルの上昇と、SARS-CoV-2のワクチン接種や感染を繰り返した後に報告されているIgG4抗体の上昇を比較するのは間違っていると結論づけられる。
The induced tolerance against the spike
protein could produce an impaired immune response against the virus when
these patients suffer a re-infection.
スパイク蛋白質に対する寛容が誘導されると、これらの患者が再感染した際にウイルスに対する免疫応答が損なわれる可能性がある。
Although the new Omicron
subvariants have a high rate of transmissibility, the severity of
infections has fortunately been reduced as a result of a change in
affinity towards the upper respiratory tract [27,133,134,135].
新しいオミクロン亜型は感染率が高いが、上気道への親和性が変化した結果、幸いにも感染の重症度は低下した [27,133,134,135]。
これらの知見は、オミクロン感染症による重篤な影響が少なかった理由を説明しているかもしれない [136,137]。
However, without an adequate protection level, even the new Omicron
sub-variants (considered as mild) could cause severe multi-organ damage
and death in immuno-compromised individuals and those with
comorbidities.
しかし、十分な防御レベルがなければ、新しいオミクロン亜型(軽症と考えられている)でさえ、免疫不全患者や併存疾患のある患者では、重篤な多臓器障害や死亡を引き起こす可能性がある。
A study by Gazit et al. found
that when the initial event (infection or vaccination) happened during
January and February of 2021, SARS-CoV-2-naive vaccinees exhibited a
13.06-fold (95% confidence interval (CI), 8.08–21.11) greater risk for
breakthrough infection with the Delta variant compared to the
unvaccinated-previously-infected persons.
Gazitらの研究によると、2021年1月と2月に最初のイベント(感染またはワクチン接種)が起こった場合、SARS-CoV-2ワクチン未接種者は、ワクチン未接種者である既感染者と比較して、デルタ変異体へのブレークスルー感染のリスクが13.06倍(95%信頼区間(CI)、8.08-21.11)高いことがわかった。
The increased risk for
symptomatic illness was also substantial.
症候性疾患のリスクもかなり高かった。
Evidence of waning naturally
generated immunity was shown when the infection happened at any point
between March 2020 and February 2021, albeit SARS-CoV-2 naive vaccinees
still had a 5.96-fold (95% CI: 4.85–7.33) higher risk of breakthrough
infection and a 7.13-fold (95% CI: 5.51–9.21) higher risk of symptomatic
disease.
2020年3月から2021年2月までのいずれかの時点で感染した場合、自然発生した免疫が衰えている証拠が示されたが、SARS-CoV-2ワクチン未接種者は依然として、破過感染リスクが5.96倍(95%信頼区間:4.85-7.33)、症候性疾患リスクが7.13倍(95%信頼区間:5.51-9.21)高かった。
This research also showed that immunity acquired through
natural disease provides better protection against infection and disease
symptoms caused by the Delta variant of SARS-CoV-2 than the immunity
provided by two injections with the BNT162b2 vaccine [138].
この研究はまた、BNT162b2ワクチン(橋本:ファイザーワクチン)の2回の注射によって得られる免疫よりも、自然疾患によって獲得された免疫の方が、SARS-CoV-2のデルタ変異体による感染と疾病症状に対してより優れた防御を提供することを示している[138]。
Even
the protection that COVID-19 vaccines provide against severe symptoms
and hospitalization is now being questioned following an outbreak in an
Israeli hospital that resulted in the deaths of five individuals (all
with comorbidities) who were fully immunized [138].
COVID-19ワクチンが重篤な症状や入院に対して提供する予防効果でさえも、イスラエルの病院で発生し、完全に予防接種を受けた5人の患者(全員が合併症を有していた)が死亡したことから、現在では疑問視されている[138]。
This study casts some doubt on the notion that widespread immunization
will produce herd immunity and stop COVID-19 outbreaks.
この研究は、広範な予防接種が集団免疫を作り出し、COVID-19の流行を食い止めるという考え方に疑問を投げかけている。
This may have
been true for the SARS-CoV-2 wild-type virus, but in the outbreak that
is the subject of the cited study, 96.2% of those who were exposed
received full vaccinations [139].
これはSARS-CoV-2野生型ウイルスでも同様であったかもしれないが、引用した研究の対象であるアウトブレイクでは、曝露された患者の96.2%が完全予防接種を受けていた [139] 。
Similarly, Brosh-Nissimov et al. reported that among 17 Israeli
hospitals, 34/152 (22%) fully immunized patients passed away from
COVID-19.
同様に、Brosh-Nissimovらは、イスラエルの17の病院のうち、34/152人(22%)の完全予防接種を受けた患者がCOVID-19で死亡したと報告している。
Noticeably, these individuals had a high prevalence of
co-morbid disorders, such as congestive heart failure, chronic renal
insufficiency, high blood pressure, diabetes, and lung disorders, that
made them more vulnerable to developing severe COVID-19 [140].
これらの患者は、うっ血性心不全、慢性腎不全、高血圧、糖尿病、肺疾患などの併存疾患の有病率が高く、重症のCOVID-19を発症しやすかった。
Irrgang et al. [30]
reported that it takes months for the IgG4 class switch to develop.
Irrgangら [30]は、IgG4クラススイッチの発現には数ヵ月かかると報告している。
Could this increase in IgG4 levels explain the reduced efficacy of mRNA
vaccines detected after 6 months [141]?
このIgG4レベルの増加は、6ヵ月後に検出されたmRNAワクチンの有効性の低下を説明できるだろうか [141] 。
Based on findings from the HIV trial [113],
where decreased vaccine efficacy was linked to IgG4 production, we
conclude that repeated mRNA vaccination is also correlated with reduced
efficacy in protecting people from re-infection due to an increase in
IgG4 levels.
ワクチン効果の低下がIgG4産生と関連していたHIV試験[113]の知見に基づき、mRNAワクチン接種の繰り返しは、IgG4レベルの上昇により再感染から人々を守る効果の低下とも相関していると結論づけた。
There is now compelling evidence
that, among COVID-19 vaccines, only the mRNA vaccines (but not the
adenoviral vector-based vaccine from AstraZeneca) induced a remarkable
increase in IgG4 levels, and such an increase was detected in SARS-CoV-2
uninfected individuals who received mRNA vaccinations before becoming
infected with the virus, whereas for patients who had a previous
infection before vaccination, IgG4 levels did not rise [31].
COVID-19ワクチンのうち、mRNAワクチン(アストラゼネカのアデノウイルスベクターベースのワクチンではない)だけがIgG4レベルの顕著な上昇を誘導し、そのような上昇は、ウイルスに感染する前にmRNAワクチン接種を受けたSARS-CoV-2未感染者で検出されたのに対し、ワクチン接種前に既感染者ではIgG4レベルは上昇しなかったという説得力のある証拠が現在得られている[31]。
This is in contrast with findings from another study showing that the
highest IgG4 levels were found in those individuals who developed a
breakthrough infection after receiving three doses of mRNA vaccination,
indicating that SARS-CoV-2 infections can also induce IgG4 production [30].
これは、mRNAワクチン接種を3回受けた後にブレークスルー感染を発症した患者でIgG4レベルが最も高かったという別の研究結果とは対照的であり、SARS-CoV-2感染もIgG4産生を誘導する可能性があることを示している[30]。
We suggest more research is needed for a definitive conclusion about these different results.
これらの異なる結果について明確な結論を出すには、さらなる研究が必要である。
The HIV [113] and malaria trials [115],
and studies with the Pertussis vaccine informed us that repeated
vaccination was linked to reduced protection from infection, and this
poor response was directly related to a higher IgG4 production.
HIV [113]やマラリア [115]の試験、百日咳ワクチンの研究から、ワクチン接種を繰り返すと感染防御が低下し、この反応不良がIgG4産生の増加と直接関係していることがわかった。
Moreover, it was suggested that this class switch might contribute to
breakthrough infections due to impaired fc-mediated antiviral responses [113].
さらに、このクラススイッチが、fcを介した抗ウイルス応答の障害による感染症のブレークスルーに関与している可能性が示唆された[113]。
All in all, reviewed data indicate that IgG4 production induced by
repeated vaccination does not in any way constitute a protective
mechanism.
これらのデータから、ワクチン接種を繰り返すことでIgG4が産生されても、それが感染防御のメカニズムになるわけではないことがわかる。
There are also warning signs in recent literature that
indicate the cellular immune response induced by the typical vaccination
course may be severely compromised by repeated administration of the
same booster shot or infection following vaccination, which, in
combination with impaired antibody immune responses, may cause
recipients’ symptoms to worsen or their disease to last longer.
また、最近の文献には、典型的なワクチン接種コースによって誘導される細胞性免疫応答が、ワクチン接種後に同じブースター注射や感染症を繰り返し投与することによって著しく損なわれる可能性を示す警告的徴候があり、抗体免疫応答の障害と相まって、被接種者の症状を悪化させたり、病気を長引かせたりする可能性がある。
Excessive vaccination is likely to create an immunosuppressive
microenvironment that is crucial for promoting immunological tolerance.
過剰なワクチン接種は、免疫寛容を促進するのに重要な免疫抑制的微小環境を作り出す可能性が高い。
These findings show that repeated SARS-CoV-2 booster immunization in
dense populations should be approached with caution [112].
これらの知見は、密集した集団におけるSARS-CoV-2ブースター免疫の反復接種には注意が必要であることを示している[112]。
We
propose a hypothetical immune tolerance mechanism induced by mRNA
vaccines, which could have at least six negative unintended
consequences:
私たちは、mRNAワクチンによって誘導される免疫寛容機構を仮説的に提案するが、この機構は少なくとも6つの意図しない負の結果をもたらす可能性がある:
(1) By ignoring the spike protein
synthesized as a consequence of vaccination, the host immune system may
become vulnerable to re-infection with the new Omicron subvariants,
allowing for free replication of the virus once a re-infection takes
place.
(1) ワクチン接種の結果として合成されたスパイクタンパク質を無視することで、宿主の免疫系は新しいオミクロン亜種への再感染に対して脆弱になり、再感染が起こるとウイルスが自由に複製できるようになる可能性がある。
In this situation, we suggest that even these less pathogenic
Omicron subvariants could cause significant harm and even death in
individuals with comorbidities and immuno-compromised conditions.
このような状況では、たとえ病原性の低いオミクロン亜型であっても、併存疾患や免疫不全のある人には重大な害を及ぼし、死に至る可能性さえあることが示唆される。
(2) mRNA and inactivated vaccines temporally impair interferon signaling [142,143],
possibly causing immune suppression and leaving the individual in a
vulnerable situation against any other pathogen.
(2)mRNAや不活化ワクチンは、インターフェロンシグナル伝達を一時的に阻害する [142,143]。
In addition, this
immune suppression could allow the re-activation of latent viral,
bacterial, or fungal infections and might also allow the uncontrolled
growth of cancer cells [144].
加えて、このような免疫抑制は、潜在的なウイルス、細菌、真菌感染の再活性化を可能にし、また、がん細胞の制御不能な増殖を可能にするかもしれない[144]。
(3)
A tolerant immune system might allow SARS-CoV-2 persistence in the host
and promote the establishment of a chronic infection, similar to that
generated by the hepatitis B virus (HBV), the human immune deficiency
virus (HIV), and the hepatitis C virus (HCV) [145].
(3)寛容な免疫システムは、SARS-CoV-2が宿主に持続することを可能にし、B型肝炎ウイルス(HBV)、ヒト免疫不全ウイルス(HIV)、C型肝炎ウイルス(HCV)によって生じるのと同様に、慢性感染の確立を促進するかもしれない[145]。
(4) The combined immune suppression (produced by SARS-CoV-2 infection [15,16,17,18,19,20,21,22] and further enhanced by vaccination [142,143,144])
could explain a plethora of autoimmune conditions, such as cancers,
re-infections, and deaths temporally associated with both.
(4)複合的な免疫抑制(SARS-CoV-2感染 [15, 16,17, 18,19, 20,21,22] によって生じ、ワクチン接種 [142,143,144] によってさらに増強される)は、がん、再感染、両者に一時的に関連した死亡などの自己免疫疾患の多さを説明しうる。
It is
conceivable that the excess deaths reported in several highly
COVID-19-vaccinated countries may be explained, in part, by this
combined immunosuppressive effect.
COVID-19ワクチン接種の多いいくつかの国で報告されている過剰死亡は、この複合的な免疫抑制効果によって部分的に説明できるかもしれない。
(5) Repeated
vaccination could also lead to auto-immunity: in 2009, the results of
an important study went largely unnoticed.
(5)ワクチン接種の繰り返しが自己免疫につながる可能性もある。2009年、ある重要な研究結果が発表されたが、ほとんど注目されなかった。
Researchers discovered that
in mice that are otherwise not susceptible to spontaneous autoimmune
disorders, repeated administration of the antigen promotes systemic
autoimmunity.
研究者らは、そうでなければ自然発生的な自己免疫疾患に罹患しないマウスにおいて、抗原の反復投与が全身の自己免疫を促進することを発見したのである。
The development of CD4+ T cells that can induce
autoantibodies (autoantibody-inducing CD4+ T cells, or aiCD4+ T cells),
which had their T cell receptors (TCR) modified, was triggered by
excessive stimulation of CD4+ T cells.
T細胞受容体(TCR)を改変された自己抗体を誘導しうるCD4+ T細胞(自己抗体誘導CD4+ T細胞、aiCD4+ T細胞)の発生は、CD4+ T細胞の過剰刺激によって引き起こされた。
The aiCD4+ T cell was generated
by new genetic TCR modification rather than a cross-reaction.
aiCD4+T細胞は、交差反応ではなく、新たな遺伝子TCR修飾によって生成された。
The
excessively stimulated CD8+ T cells induced them to develop into
cytotoxic T lymphocytes (CTL) that are specific for an antigen.
過剰に刺激されたCD8+ T細胞は、抗原に特異的な細胞傷害性Tリンパ球(CTL)へと発達するように誘導された。
These
CTLs were able to mature further by antigen cross-presentation, so in
that situation, they induced autoimmune tissue damage resembling
systemic lupus erythematosus (SLE) [146].
これらのCTLは抗原の交差提示によってさらに成熟することができたので、そのような状況では、全身性エリテマトーデス(SLE)に似た自己免疫組織障害を誘発した。
According to the self-organized criticality theory, when the immune
system of the host is continually overstimulated by antigen exposure at
concentrations higher than the immune system’s self-organized
criticality can tolerate, systemic autoimmunity inevitably occurs [147].
自己組織化臨界性理論によれば、宿主の免疫系が、免疫系の自己組織化臨界性が許容できる以上の濃度で抗原に暴露され、過剰な刺激を受け続けると、必然的に全身性の自己免疫が起こる。
It
has been proposed that the amount and duration of the spike protein
produced are presumably affected by the higher mRNA concentrations in
the mRNA-1273 vaccine (100 µg) compared to the BNT162b2 vaccine (30 µg) [31].
産生されるスパイクタンパク質の量と持続時間は、BNT162b2ワクチン(30μg)に比べてmRNA-1273ワクチン(100μg)のmRNA濃度が高いことが影響していると推定されると提唱されている[31]。
Thus, it is probable that the spike protein produced in response to
mRNA vaccination is too high and lasts too long in the body.
したがって、mRNAワクチン接種に反応して産生されるスパイク蛋白質は、体内で高すぎ、長く持続しすぎる可能性がある。
その結果、免疫系の能力が過剰になり、自己免疫につながる可能性がある [146,147]。
Indeed, several investigations have found that COVID-19 immunization is
associated with the development of autoimmune responses [148,149,150,151,152,153,154,155,156,157,158,159,160,161,162,163,164,165,166].
実際、いくつかの調査で、COVID-19の免疫化が自己免疫反応の発現と関連していることが判明している[148,149, 150,151, 152,153,154,155,156,157,158,159,160, 161, 162,163,164,165,166]。
(6)
Increased IgG4 levels induced by repeated vaccination could lead to
autoimmune myocarditis; it has been suggested that IgG4 antibodies can
also cause an autoimmune reaction by impeding the immune system’s
ability to be suppressed by regulatory T cells [102].
(6) ワクチン接種の繰り返しによって誘発されるIgG4レベルの上昇は、自己免疫性心筋炎を引き起こす可能性がある。IgG4抗体は、制御性T細胞によって抑制される免疫系の能力を阻害することによっても、自己免疫反応を引き起こす可能性が示唆されている[102]。
Patients using immune checkpoint inhibitors alone or in combination have been linked to occurrences of acute myocarditis [103,104,105,106,107], sometimes with lethal consequences [102].
免疫チェックポイント阻害薬を単独または併用した患者は、急性心筋炎を発症し [103,104,105,106,107] 、時には致死的な結果をもたらすことがある [102] 。
As anti-PD-1 antibodies are class IgG4, and these antibodies are also
induced by repeated vaccination, it is plausible to suggest that
excessive vaccination could be associated with the occurrence of an
increased number of myocarditis cases and sudden cardiac deaths.
抗PD-1抗体はIgG4クラスであり、これらの抗体はワクチン接種を繰り返すことによっても誘導されることから、過剰なワクチン接種が心筋炎症例の増加や心臓突然死の発生に関連している可能性を示唆するのはもっともである。
Finally,
these negative outcomes are not expected to affect all people who have
received these mRNA vaccines.
最後に、これらのネガティブな結果は、mRNAワクチンを接種した全ての人に影響するわけではありません。
Individuals with genetic susceptibility,
immune deficiencies, and comorbidities are probably the most likely to
be affected.
遺伝的感受性のある人、免疫不全のある人、合併症のある人がおそらく最も影響を受けやすい。
However, this gives rise to a disturbing paradox—if people
who are the most affected by the COVID-19 disease (the elderly,
diabetics, hypertensive, and immunocompromised people like those with
HIV) are also more susceptible to suffering the negative effects of
repeated mRNA vaccination, is it then justified to booster them?
COVID-19の影響を最も受けやすい人たち(高齢者、糖尿病患者、高血圧患者、HIV感染者のような免疫不全者)が、mRNAワクチン接種の繰り返しによる悪影響を受けやすいとしたら、その人たちをブースター接種することは正当化されるのだろうか?
As
Omicron subvariants have been demonstrated to be less pathogenic [133,134,135,136,137], and mRNA vaccines do not protect against re-infection [14,138], clinicians should be aware of the possible detrimental effects on the immune system by administering boosters.
オミクロン亜型は病原性が低いことが証明されており[133,134,135,136,137]、mRNAワクチンは再感染を予防しない[14,138]ので、臨床医はブースターを投与することで免疫系に悪影響を及ぼす可能性があることを認識しておく必要がある。
Author Contributions
Conceptualization,
A.R.-C. and V.N.U.; validation, A.R.-C., E.M.R., W.M. and V.N.U.;
formal analysis, A.R.-C., W.M., E.M.R. and V.N.U.; literature search,
A.R.-C., E.M.R. and V.N.U.; data curation, A.R.-C., E.M.R. and V.N.U.;
writing—original draft preparation, A.R.-C. and V.N.U.; writing—review
and editing, A.R.-C., E.M.R., W.M. and V.N.U.; visualization, A.R.-C.;
supervision, A.R.-C. and V.N.U. All authors have read and agreed to the
published version of the manuscript.
目次
https://www.mdpi.com/2076-393X/11/5/991
IgG4 Antibodies Induced by Repeated Vaccination May Generate Immune Tolerance to the SARS-CoV-2 Spike Protein
繰り返されるワクチン接種により産生されるIgG4はSARS-CoV-2 Spike Proteinに対する免疫寛容を誘起する可能性がある
Abstract
Introduction
2. Characteristics of the Unusual IgG4 Antibody2. 特異なIgG4抗体の特徴
2.1.2. IgG4-Related Disease and Its Pathogenesis 2.1.2. IgG4関連疾患とその病態
IgG4 Role in Cancer 癌におけるIgG4の役割
3. The Role of IgG4 Antibodies Induced by Different Vaccines 3. 異なるワクチンによって誘導されるIgG4抗体の役割
3.2. Repeated Vaccination 3.2. 反復接種
3.2.1. Repeated Inoculation with COVID-19 Vaccines 3.2.1. COVID-19ワクチンの反復接種
3.2.2. Repeated Inoculation with HIV Vaccines (3.2.2. HIVワクチンの反復接種)
HIVワクチン、マラリアワクチンの反復接種、使用したワクチンの種類に関する知見


0 件のコメント:
コメントを投稿